La corrosión de los metales
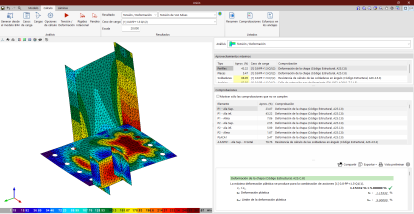
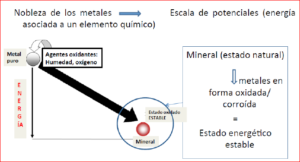
Que un metal se oxide, es natural. Lo raro es encontrar un metal en estado puro. Pensemos que los minerales naturales, como la bauxita, la pirita, la blenda o la galena, no son otra cosa que minerales que contienen metales, aluminio, azufre, zinc o plomo, en estado oxidado. Las civilizaciones neolíticas, en sus diferentes edades, de bronce y hierro, aprenden a separar la ganga del verdadero metal, ahora con ayuda del fuego, en estado de gran pureza. Vemos pues que, para purificarlo, desde su estado de oxidación hemos de aportar energía, a través del fuego. Pero si este metal, en estado puro lo dejamos en la intemperie, tiende a volver a su estado original oxidándose.

Aunque también es cierto que, no todos tienen la misma facilidad a la oxidación. Es por eso que existen los llamados metales nobles. Los metales nobles son un grupo de metales caracterizados por ser muy inertes químicamente, es decir, que no reaccionan químicamente (o reaccionan muy poco) con otros compuestos químicos, lo que los convierte en metales muy interesantes para muchos fines tecnológicos o para joyería. Esta propiedad se traduce en una escasa reactividad, o lo que es lo mismo, son poco susceptibles de corroerse y oxidarse, lo que les proporciona apariencia de inalterabilidad, razón por la cual se les denomina con el apelativo de nobles. Entre ellos el oro, es el más emblemático.
Esta nobleza de los metales, se combina con otra característica interesante. Luigi Galvani (1734-1798),médico biólogo, descubrió la relación entre la electricidad y el sistema nervioso animal. Entre sus experimentos, aplicaba a través de un metal, una descarga eléctrica sobre una rana muerta, y ésta reaccionaba al estímulo eléctrico contrayendo la musculatura. Sus controversias con su contemporáneo Alessandro Volta, les llevan a inaugurar una nueva rama de la ciencia que tiene que ver con diversas aplicaciones eléctricas, siendo una de sus consecuencias colaterales la conocida novela de Mary Sheeley, Frankestein, que reanima su criatura mediante las telúricas fuerzas eléctricas de la atmosfera desatada en plena tormenta.

La gran fuerza de la electricidad, en la novela de Frankestein
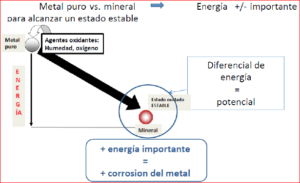
Vemos pues que no todos los metales tienen las mismas propiedades, a pesar de ser todos ellos buenos conductores de la electricidad, siendo el cobre el mejor de todos ellos. Por tanto vemos que para pasar de un metal puro a otro oxidado, se ha de producir la corrosión, y esto supone una variación, aumento o una disminución, de su estado energético.
Existencia de una diferencia de potencial eléctrico entre los dos estados puro-oxidado de un metal
De ahí nace el concepto de la conocida
Serie Galvánica. En la reacción Redox, se operan dos semireacciones a la vez, una que es la propia oxidación, en donde el metal pierde electrones, y otra semireacción, la reducción donde el otro metal los capta. Pero hemos visto que en concepto de “nobleza” del metal, no todos tienen el mismo comportamiento. Si ordenamos los metales según su tendencia a sufrir corrosión, obtendremos la llamada serie galvánica. Cuando dos metales están en contacto con un electrolito, y conectados eléctricamente, el menos noble experimentará la corrosión galvánica, mientras que el más noble se verá favorecido y protegido.
En la serie galvánica, los metales más nobles aparecen en la parte alta, y puestos en contacto con otros metales de menor nobleza, ambos en contacto de un electrolito, son capaces de corroerlos. Existe una medida en electroquímica que se conoce como
Potencial normal de un electrodo o Potencial normal de reducción del electrodo de un elemento, abreviadamente E
0 (superíndice 0, por “normal” o standard), como la diferencia de potencial que le corresponde a una celda o semipila construida con un electrodo de este elemento y un electrodo standard de hidrógeno, cuando la concentración efectiva es de 1 mol/l ( concentración 1 Molar)), a una presión de 1 atm y a una temperatura de 298ºK(25ºC).
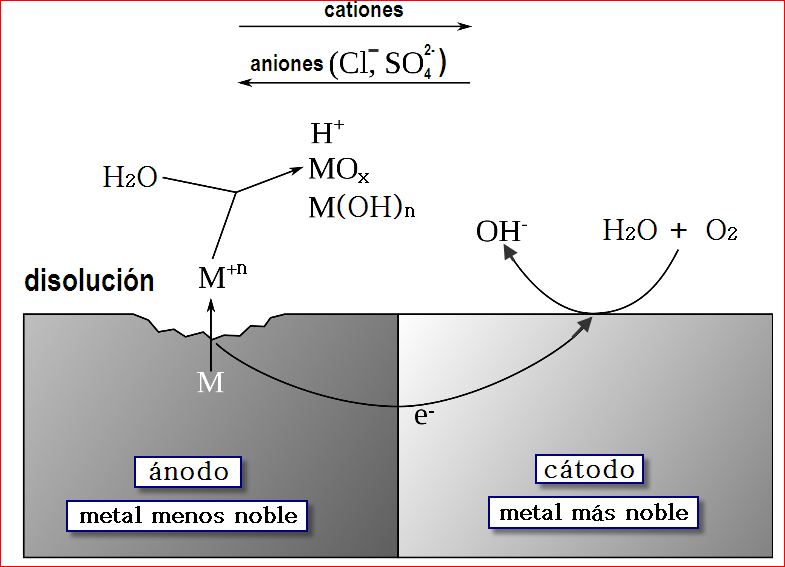
Par galvánico en presencia de un electrolito
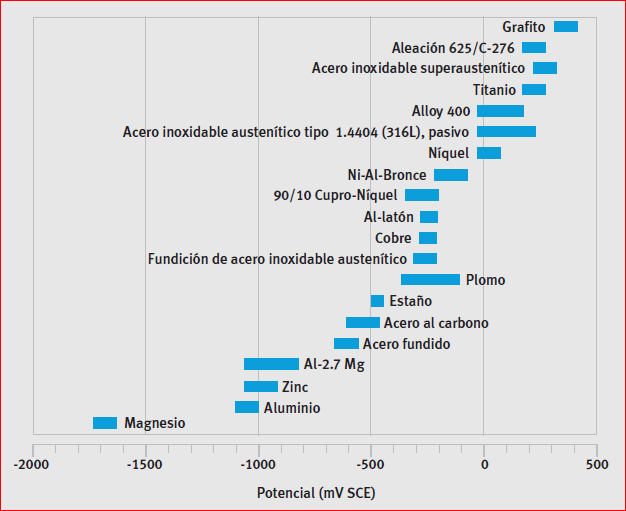
Serie galvánica en presencia de agua de mar actuando como electrolito
Continuar "Protección en las estructuras metálicas (III)"
aquí.


 Aunque también es cierto que, no todos tienen la misma facilidad a la oxidación. Es por eso que existen los llamados metales nobles. Los metales nobles son un grupo de metales caracterizados por ser muy inertes químicamente, es decir, que no reaccionan químicamente (o reaccionan muy poco) con otros compuestos químicos, lo que los convierte en metales muy interesantes para muchos fines tecnológicos o para joyería. Esta propiedad se traduce en una escasa reactividad, o lo que es lo mismo, son poco susceptibles de corroerse y oxidarse, lo que les proporciona apariencia de inalterabilidad, razón por la cual se les denomina con el apelativo de nobles. Entre ellos el oro, es el más emblemático.
Esta nobleza de los metales, se combina con otra característica interesante. Luigi Galvani (1734-1798),médico biólogo, descubrió la relación entre la electricidad y el sistema nervioso animal. Entre sus experimentos, aplicaba a través de un metal, una descarga eléctrica sobre una rana muerta, y ésta reaccionaba al estímulo eléctrico contrayendo la musculatura. Sus controversias con su contemporáneo Alessandro Volta, les llevan a inaugurar una nueva rama de la ciencia que tiene que ver con diversas aplicaciones eléctricas, siendo una de sus consecuencias colaterales la conocida novela de Mary Sheeley, Frankestein, que reanima su criatura mediante las telúricas fuerzas eléctricas de la atmosfera desatada en plena tormenta.
Aunque también es cierto que, no todos tienen la misma facilidad a la oxidación. Es por eso que existen los llamados metales nobles. Los metales nobles son un grupo de metales caracterizados por ser muy inertes químicamente, es decir, que no reaccionan químicamente (o reaccionan muy poco) con otros compuestos químicos, lo que los convierte en metales muy interesantes para muchos fines tecnológicos o para joyería. Esta propiedad se traduce en una escasa reactividad, o lo que es lo mismo, son poco susceptibles de corroerse y oxidarse, lo que les proporciona apariencia de inalterabilidad, razón por la cual se les denomina con el apelativo de nobles. Entre ellos el oro, es el más emblemático.
Esta nobleza de los metales, se combina con otra característica interesante. Luigi Galvani (1734-1798),médico biólogo, descubrió la relación entre la electricidad y el sistema nervioso animal. Entre sus experimentos, aplicaba a través de un metal, una descarga eléctrica sobre una rana muerta, y ésta reaccionaba al estímulo eléctrico contrayendo la musculatura. Sus controversias con su contemporáneo Alessandro Volta, les llevan a inaugurar una nueva rama de la ciencia que tiene que ver con diversas aplicaciones eléctricas, siendo una de sus consecuencias colaterales la conocida novela de Mary Sheeley, Frankestein, que reanima su criatura mediante las telúricas fuerzas eléctricas de la atmosfera desatada en plena tormenta.
 La gran fuerza de la electricidad, en la novela de Frankestein
Vemos pues que no todos los metales tienen las mismas propiedades, a pesar de ser todos ellos buenos conductores de la electricidad, siendo el cobre el mejor de todos ellos. Por tanto vemos que para pasar de un metal puro a otro oxidado, se ha de producir la corrosión, y esto supone una variación, aumento o una disminución, de su estado energético.
La gran fuerza de la electricidad, en la novela de Frankestein
Vemos pues que no todos los metales tienen las mismas propiedades, a pesar de ser todos ellos buenos conductores de la electricidad, siendo el cobre el mejor de todos ellos. Por tanto vemos que para pasar de un metal puro a otro oxidado, se ha de producir la corrosión, y esto supone una variación, aumento o una disminución, de su estado energético.
 Existencia de una diferencia de potencial eléctrico entre los dos estados puro-oxidado de un metal
Existencia de una diferencia de potencial eléctrico entre los dos estados puro-oxidado de un metal
 De ahí nace el concepto de la conocida Serie Galvánica. En la reacción Redox, se operan dos semireacciones a la vez, una que es la propia oxidación, en donde el metal pierde electrones, y otra semireacción, la reducción donde el otro metal los capta. Pero hemos visto que en concepto de “nobleza” del metal, no todos tienen el mismo comportamiento. Si ordenamos los metales según su tendencia a sufrir corrosión, obtendremos la llamada serie galvánica. Cuando dos metales están en contacto con un electrolito, y conectados eléctricamente, el menos noble experimentará la corrosión galvánica, mientras que el más noble se verá favorecido y protegido.
En la serie galvánica, los metales más nobles aparecen en la parte alta, y puestos en contacto con otros metales de menor nobleza, ambos en contacto de un electrolito, son capaces de corroerlos. Existe una medida en electroquímica que se conoce como Potencial normal de un electrodo o Potencial normal de reducción del electrodo de un elemento, abreviadamente E0 (superíndice 0, por “normal” o standard), como la diferencia de potencial que le corresponde a una celda o semipila construida con un electrodo de este elemento y un electrodo standard de hidrógeno, cuando la concentración efectiva es de 1 mol/l ( concentración 1 Molar)), a una presión de 1 atm y a una temperatura de 298ºK(25ºC).
De ahí nace el concepto de la conocida Serie Galvánica. En la reacción Redox, se operan dos semireacciones a la vez, una que es la propia oxidación, en donde el metal pierde electrones, y otra semireacción, la reducción donde el otro metal los capta. Pero hemos visto que en concepto de “nobleza” del metal, no todos tienen el mismo comportamiento. Si ordenamos los metales según su tendencia a sufrir corrosión, obtendremos la llamada serie galvánica. Cuando dos metales están en contacto con un electrolito, y conectados eléctricamente, el menos noble experimentará la corrosión galvánica, mientras que el más noble se verá favorecido y protegido.
En la serie galvánica, los metales más nobles aparecen en la parte alta, y puestos en contacto con otros metales de menor nobleza, ambos en contacto de un electrolito, son capaces de corroerlos. Existe una medida en electroquímica que se conoce como Potencial normal de un electrodo o Potencial normal de reducción del electrodo de un elemento, abreviadamente E0 (superíndice 0, por “normal” o standard), como la diferencia de potencial que le corresponde a una celda o semipila construida con un electrodo de este elemento y un electrodo standard de hidrógeno, cuando la concentración efectiva es de 1 mol/l ( concentración 1 Molar)), a una presión de 1 atm y a una temperatura de 298ºK(25ºC).
 Par galvánico en presencia de un electrolito
Par galvánico en presencia de un electrolito
 Serie galvánica en presencia de agua de mar actuando como electrolito
Continuar "Protección en las estructuras metálicas (III)"
Serie galvánica en presencia de agua de mar actuando como electrolito
Continuar "Protección en las estructuras metálicas (III)"